Variación genética humana

| Genética humana | ||
|---|---|---|
| Subtemas | ||
La variación genética humana es la diferencia genética presente en y entre las poblaciones. Puede haber múltiples variantes de cualquier gen en la población humana (alelos), una situación llamada polimorfismo.
No hay dos humanos genéticamente idénticos. Incluso los gemelos monocigóticos (que se desarrollan a partir de un cigoto) tienen diferencias genéticas poco frecuentes debido a las mutaciones que ocurren durante el desarrollo y la variación del número de copias del gen.[1] Las diferencias entre los individuos, incluso los individuos estrechamente relacionados, son la clave de técnicas como la huella genética. A partir de 2017, hay un total de 324 millones de variantes conocidas de genomas humanos secuenciados.[2] A partir de 2015, la diferencia típica entre los genomas de dos individuos se estimó en 20 millones de pares de bases (o 0.6% del total de 3200 millones de pares de bases).[3]
Los alelos ocurren en diferentes frecuencias en diferentes poblaciones humanas. Las poblaciones que son más remotas geográficamente y ancestralmente tienden a diferir más. Las diferencias entre las poblaciones representan una pequeña proporción de la variación genética humana general. Las poblaciones también difieren en la cantidad de variación entre sus miembros. La mayor divergencia entre las poblaciones se encuentra en el África subsahariana, en consonancia con el reciente origen africano de las poblaciones no africanas. Las poblaciones también varían en la proporción y el lugar de los genes introgresados que recibieron por mezcla arcaica tanto dentro como fuera de África.
El estudio de la variación genética humana tiene importancia evolutiva y aplicaciones médicas. Puede ayudar a los científicos a comprender las antiguas migraciones de la población humana, así como la forma en que los grupos humanos están biológicamente relacionados entre sí. Para la medicina, el estudio de la variación genética humana puede ser importante porque algunas variantes de cualquier gen en la población humana (alelos) causantes de enfermedades, ocurren con mayor frecuencia en personas de regiones geográficas específicas. Nuevos hallazgos muestran que cada humano tiene en promedio 60 nuevas mutaciones en comparación con sus padres.[4][5]
Causas de variación
[editar]Las causas de las diferencias entre los individuos incluyen una variedad independiente, el intercambio de genes (cruce y recombinación) durante la reproducción (a través de la meiosis) y varios eventos mutacionales.
Existen al menos tres razones por las cuales existe variación genética entre poblaciones. La selección natural puede conferir una ventaja adaptativa a las personas en un entorno específico si un alelo proporciona una ventaja competitiva. Es probable que los alelos bajo selección ocurran solo en aquellas regiones geográficas donde confieren una ventaja. Un segundo proceso importante es la deriva genética, que es el efecto de cambios aleatorios en el conjunto de genes, en condiciones en las que la mayoría de las mutaciones son neutrales (es decir, no parecen tener ningún efecto selectivo positivo o negativo en el organismo). Finalmente, las poblaciones migrantes pequeñas tienen diferencias estadísticas, llamadas el efecto fundador, de las poblaciones generales donde se originaron; cuando estos migrantes se establecen en nuevas áreas, su población descendiente generalmente difiere de su población de origen: predominan los diferentes genes y es menos genéticamente diversa.
En humanos, la causa principal es deriva genética. Los efectos fundadores seriales y el pequeño tamaño de la población anterior (que aumenta la probabilidad de deriva genética) pueden haber tenido una influencia importante en las diferencias neutrales entre las poblaciones. La segunda causa principal de variación genética se debe al alto grado de neutralidad de la mayoría de las mutaciones. Parece que un número pequeño pero significativo de genes se ha sometido a una selección natural reciente, y estas presiones selectivas a veces son específicas de una región.[6][7]
Medidas de variación
[editar]La variación genética entre humanos ocurre en muchas escalas, desde alteraciones graves en el cariotipo humano hasta cambios en un solo nucleótido.[8] Se detectan anomalías cromosómicas en 1 de 160 nacimientos humanos vivos. Además de los trastornos de los cromosomas sexuales, la mayoría de los casos de aneuploidía provocan la muerte del feto en desarrollo (aborto espontáneo); los cromosomas autosómicos adicionales más comunes entre los nacidos vivos son 21, 18 y 13.[9]
La diversidad de nucleótidos es la proporción promedio de nucleótidos que difieren entre dos individuos. A partir de 2004, la diversidad de nucleótidos humanos se estimó en 0.1%[10] a 0.4% de pares de bases.[11] En 2015, el Proyecto 1000 Genomas, que secuenciaba a mil individuos de 26 poblaciones humanas, encontró que:
"...un genoma [individual] típico difiere del genoma humano de referencia en 4.1 millones a 5.0 millones de sitios ... que afectan a 20 millones de bases de secuencia"
La última cifra corresponde al 0,6% del número total de pares de bases.[3] Casi todos (>99.9%) de estos sitios son pequeñas diferencias, ya sea polimorfismos de un solo nucleótido o breves inserciones o deleciones (indeles) en la secuencia genética, pero las variaciones estructurales representan un mayor número de pares de bases que los SNP y los indeles.[12]
A partir de 2017, la Single Nucleotide Polymorphism Database (DbSNP), que enumera SNP y otras variantes, enumeró 324 millones de variantes encontradas en genomas humanos secuenciados.[2]
Polimorfismos de un solo nucleótido
[editar]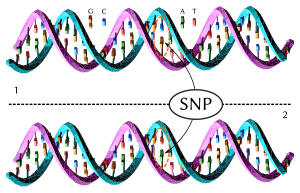
Un polimorfismo de un solo nucleótido (SNP del inglés Single Nucleotide Polymorphism) es una diferencia en un solo nucleótido entre los miembros de una especie que ocurre en al menos el 1% de la población. Las 2.504 personas caracterizadas por el "Proyecto 1000 Genomas" tenían 84.7 millones de SNP entre ellos.[3] Los SNP son el tipo más común de variación de secuencia, estimado en 1998 para representar el 90% de todas las variantes de secuencia.[13] Otras variaciones de secuencia son intercambios, eliminaciones e inserciones de base única.[14] Los SNP ocurren en promedio cada 100 a 300 bases[15] y, por lo tanto, son la principal fuente de heterogeneidad.
Un SNP funcional, o no sinónimo, es aquel que afecta algún factor, como el empalme de genes o el ARN mensajero, y por lo tanto causa una diferencia fenotípica entre los miembros de la especie. Alrededor del 3% al 5% de los SNP humanos son funcionales (ver Proyecto Internacional HapMap). Los SNP neutros o sinónimos siguen siendo útiles como marcadores genéticos en los estudios de asociación de todo el genoma, debido a su gran número y la herencia estable a lo largo de las generaciones.[13]
Un SNP de codificación es uno que ocurre dentro de un gen. Hay 105 SNP de referencia humana que resultan en codones de parada prematuros en 103 genes. Esto corresponde al 0,5% de los SNP de codificación. Ocurren debido a la duplicación segmentaria en el genoma. Estos SNP resultan en la pérdida de proteínas, sin embargo, todos estos alelos SNP son comunes y no se purifican en la selección negativa.[16]
Variación estructural
[editar]La variación estructural es la variación en la estructura del cromosoma de un organismo. Las variaciones estructurales, como la variación y las deleciones del número de copias, las inversiones, las inserciones y las duplicaciones, representan mucha más variación genética humana que la diversidad de un solo nucleótido. Esto se concluyó en 2007 del análisis de las secuencias completas diploides de los genomas de dos humanos: Craig Venter y James D. Watson. Esto se sumó a las dos secuencias haploides, que eran amalgamas de secuencias de muchos individuos, publicadas por Human Genome Project y Celera Genomics, respectivamente.[17]
De acuerdo con el Proyecto 1000 Genomas, un humano típico tiene entre 2,100 y 2,500 variaciones estructurales, que incluyen aproximadamente 1,000 deleciones grandes, 160 variantes de número de copias, 915 inserciones Alu, 128 inserciones L1, 51 inserciones SVA, 4 NUMT sy 10 inversiones.[3]
Variación de número de copia
[editar]Una variación del número de copias (CNV, del inglés copy-number variation) es una diferencia en el genoma debido a la eliminación o duplicación de grandes regiones de ADN en algunos cromosomas. Se estima que el 0,4% de los genomas de humanos no relacionados difieren con respecto al número de copias. Cuando se incluye la variación del número de copias, la variación genética de humano a humano se estima en al menos 0.5% (99.5% de similitud).[18][19][20][21] Las variaciones del número de copias se heredan, pero también pueden surgir durante el desarrollo.[22][23][24][25]
Se construyó un mapa visual con las regiones con alta variación genómica del conjunto de referencia humano-moderno en relación con un Neandertal de 50k.[26][27]
Epigenética
[editar]La variación epigenética es la variación en las etiquetas químicas que se adhieren al ADN y afectan la forma en que se leen los genes. Las etiquetas, "llamadas marcas epigenéticas, actúan como interruptores que controlan cómo se pueden leer los genes".[28] En algunos alelos, el estado epigenético del ADN y el fenotipo asociado pueden heredarse de generación en generación.[29]
Variabilidad genética
[editar]La variabilidad genética es una medida de la tendencia de los genotipos individuales en una población a variar (volverse diferente) entre sí. La variabilidad es diferente de la diversidad genética, que es la cantidad de variación observada en una población particular. La variabilidad de un rasgo es cuánto tiende a variar ese rasgo en respuesta a las influencias ambientales y genéticas.
Clinas
[editar]En biología, una clina (también cline) es un continuo de especies, poblaciones, razas, variedades o formas de organismos que exhiben diferencias fenotípicas y/o genéticas graduales en un área geográfica, típicamente como resultado de la heterogeneidad ambiental.[30][31] En el estudio científico de la variación genética humana, un gen cline puede definirse rigurosamente y someterse a métricas cuantitativas.
Haplogrupos
[editar]En el estudio de la evolución molecular, un haplogrupo es un grupo de haplotipos similares que comparten un ancestro común con una mutación de polimorfismo de un solo nucleótido (SNP). Los haplogrupos pertenecen a profundos orígenes ancestrales que datan de miles de años.[32]
Los haplogrupos humanos más comúnmente estudiados son los haplogrupos de cromosoma Y (ADN-Y) y los haplogrupos de ADN mitocondrial (ADNmt), que pueden usarse para definir poblaciones genéticas. El ADN-Y se transmite únicamente a lo largo de la línea patrilineal, de padre a hijo, mientras que el ADNmt se transmite por la línea matrilineal, de madre a hija o hijo. El ADN-Y y el ADNmt pueden cambiar por mutación fortuita en cada generación.
Número variable de repeticiones en tándem
[editar]Una repetición en tándem de número variable (VNTR) es la variación de la longitud de una repetición en tándem. Una repetición en tándem es la repetición adyacente de una secuencia corta de nucleótidos. Las repeticiones en tándem existen en muchos cromosomas, y su longitud varía entre los individuos. Cada variante actúa como un alelo heredado, por lo que se utilizan para la identificación personal o parental. Su análisis es útil en investigación de genética y biología, análisis forense y huellas de ADN.
Las repeticiones en tándem cortas (aproximadamente 5 pares de bases) se llaman microsatélites, mientras que las más largas se llaman minisatélites.
Historia y distribución geográfica
[editar]

Origen africano reciente de los humanos modernos
[editar]El paradigma del origen africano de los humanos modernos supone la dispersión de poblaciones no africanas de humanos anatómicamente modernos después de hace 70,000 años. La dispersión dentro de África ocurrió significativamente antes, hace al menos 130,000 años. La teoría de "fuera de África" se origina en el siglo XIX, como una sugerencia tentativa en Origen del hombre de Charles Darwin,[33] pero se mantuvo especulativa hasta la década de 1980, cuando fue respaldada por el estudio del ADN mitocondrial actual, combinado con evidencia de antropología física de especímenes arcaicos.
Según un estudio de 2000 de la variación de la secuencia del cromosoma Y,[34] los cromosomas Y humanos rastrean ascendencia a África, y los descendientes del linaje derivado abandonaron África y finalmente fueron reemplazados por cromosomas Y humanos arcaicos en Eurasia. El estudio también muestra que una minoría de las poblaciones contemporáneas en África Oriental y los Joisán son los descendientes de los patrilinajes más ancestrales de humanos anatómicamente modernos que abandonaron África hace 35,000 a 89,000 años. Otra evidencia que respalda la teoría es que las variaciones en las mediciones del cráneo disminuyen con la distancia desde África al mismo ritmo que la disminución de la diversidad genética. La diversidad genética humana disminuye en las poblaciones nativas con distancia migratoria de África, y se cree que esto se debe a cuellos de botella durante la migración humana, que son eventos que reducen temporalmente el tamaño de la población.[35][36]
Un estudio de agrupamiento genético de 2009, que genotipificó 1327 marcadores polimórficos en varias poblaciones africanas, identificó seis grupos ancestrales. La agrupación correspondía estrechamente con el origen étnico, la cultura y el idioma.[37] Un estudio de secuenciación del genoma completo de 2018 de las poblaciones del mundo observó grupos similares entre las poblaciones de África. En K = 9, distintos componentes ancestrales definieron las poblaciones de habla afroasiática que habitan el norte de África y el noreste de África; las poblaciones de habla nilo-sahariana en el noreste de África y África oriental; las poblaciones de Ari en el noreste de África; las poblaciones que hablan Níger-Congo en África occidental central, África occidental, África oriental y África meridional; las poblaciones pigmeas en África Central; y las poblaciones khoisan en el sur de África.[38]
Genética de poblaciones
[editar]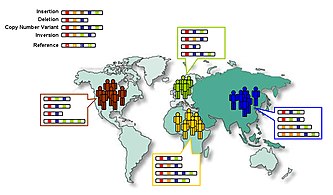
Debido a la ascendencia común de todos los humanos, solo un pequeño número de variantes tienen grandes diferencias de frecuencia entre las poblaciones. Sin embargo, algunas variantes raras en la población humana del mundo son mucho más frecuentes en al menos una población (más del 5%).[39]
Se supone comúnmente que los primeros humanos abandonaron África y, por lo tanto, deben haber atravesado un cuello de botella en la población antes de su divergencia entre África y Eurasia hace unos 100,000 años (aproximadamente 3,000 generaciones). La rápida expansión de una población previamente pequeña tiene dos efectos importantes en la distribución de la variación genética. Primero, el llamado efecto fundador ocurre cuando las poblaciones fundadoras solo traen un subconjunto de la variación genética de su población ancestral. En segundo lugar, a medida que los fundadores se separan más geográficamente, la probabilidad de que dos individuos de diferentes poblaciones fundadoras se apareen se hace más pequeña. El efecto de este apareamiento selectivo es reducir el flujo de genes entre grupos geográficos y aumentar la distancia genética entre grupos.
La expansión de los humanos desde África afectó la distribución de la variación genética de otras dos formas. Primero, las poblaciones más pequeñas (fundadoras) experimentan una mayor deriva genética debido a las mayores fluctuaciones en los polimorfismos neutros. En segundo lugar, los nuevos polimorfismos que surgieron en un grupo tenían menos probabilidades de transmitirse a otros grupos debido a que el flujo de genes estaba restringido.
Las poblaciones en África tienden a tener menores cantidades de desequilibrio de enlace que las poblaciones fuera de África, en parte debido al mayor tamaño de las poblaciones humanas en África a lo largo de la historia humana y en parte debido a que el número de humanos modernos que abandonaron África para colonizar el resto del mundo parece haber sido relativamente bajo.[40] En contraste, las poblaciones que han experimentado reducciones de tamaño dramáticas o expansiones rápidas en el pasado y las poblaciones formadas por la mezcla de grupos ancestrales previamente separados pueden tener niveles inusualmente altos de desequilibrio de ligamiento.
Distribución de la variación
[editar]
La distribución de variantes genéticas dentro y entre las poblaciones humanas es imposible de describir de manera sucinta debido a la dificultad de definir una "población", la naturaleza clinal de la variación y la heterogeneidad en todo el genoma. Sin embargo, en general, existe un promedio de 85% de variación genética dentro de las poblaciones locales, ~7% es entre poblaciones locales dentro del mismo continente, y ~8% de variación ocurre entre grupos grandes que viven en diferentes continentes.[41][42] La teoría del origen africano para los humanos predeciría que en África existe mucha más diversidad que en otros lugares y que la diversidad debería disminuir cuanto más lejos de África se muestrea una población.
Variación fenotípica
[editar]El África subsahariana tiene la mayor diversidad genética humana y lo mismo se ha demostrado que es válido para la variación fenotípica en la forma del cráneo.[35][43] El fenotipo está conectado al genotipo a través de la expresión génica. La diversidad genética disminuye suavemente con la distancia migratoria desde esa región, que muchos científicos creen que es el origen de los humanos modernos, y esa disminución se refleja en una disminución en la variación fenotípica. Las mediciones del cráneo son un ejemplo de un atributo físico cuya variación dentro de la población disminuye con la distancia desde África.
La distribución de muchos rasgos físicos se asemeja a la distribución de la variación genética dentro y entre las poblaciones humanas (Asociación Americana de Antropólogos Físicos, 1996).[44] Por ejemplo, ~90% de la variación en las formas de la cabeza humana ocurre dentro de los grupos continentales, y ~10% separa los grupos, con una mayor variabilidad de la forma de la cabeza entre individuos con antepasados africanos recientes.[45]
Una excepción prominente a la distribución común de las características físicas dentro y entre los grupos es el color de la piel. Aproximadamente el 10% de la variación en el color de la piel ocurre dentro de los grupos, y ~90% ocurre entre los grupos. Esta distribución del color de la piel y su patrón geográfico, con personas cuyos antepasados vivieron predominantemente cerca del ecuador que tienen una piel más oscura que aquellos con antepasados que vivieron predominantemente en latitudes más altas, indican que este atributo ha estado bajo una fuerte presión selectiva. La piel más oscura parece estar fuertemente seleccionada en regiones ecuatoriales para prevenir las quemaduras solares, el cáncer de piel, la fotólisis del folato y el daño a las glándulas sudoríparas.[46]
Comprender cómo la diversidad genética en la población humana impacta varios niveles de expresión génica es un área activa de investigación. Si bien los estudios anteriores se centraron en la relación entre la variación del ADN y la expresión del ARN, los esfuerzos más recientes caracterizan el control genético de varios aspectos de la expresión génica, incluidos los estados de cromatina,[47] traducción,[48] y los niveles de proteína.[49] Un estudio publicado en 2007 encontró que el 25% de los genes mostraron diferentes niveles de expresión génica entre poblaciones de ascendencia europea y asiática.[50][51][52][53][54] Se pensaba que la causa principal de esta diferencia en la expresión génica eran los SNP en las regiones reguladoras de genes del ADN. Otro estudio publicado en 2007 encontró que aproximadamente el 83% de los genes se expresaron en diferentes niveles entre individuos y aproximadamente el 17% entre poblaciones de ascendencia europea y africana.[55][56]
Índice de fijación de Wright como medida de variación
[editar]El genetista de poblaciones Sewall Wright desarrolló el índice de fijación (a menudo abreviado como FST) como una forma de medir las diferencias genéticas entre las poblaciones. Esta estadística a menudo se usa en taxonomía para comparar las diferencias entre dos poblaciones dadas midiendo las diferencias genéticas entre poblaciones para genes individuales, o para muchos genes simultáneamente.[57] A menudo se afirma que el índice de fijación para los humanos es de aproximadamente 0,15. Esto se traduce en un estimado del 85% de la variación medida en la población humana en general se encuentra en individuos de la misma población, y aproximadamente el 15% de la variación ocurre entre poblaciones. Estas estimaciones implican que dos individuos de diferentes poblaciones tienen casi la misma probabilidad de ser más similares entre sí que cualquiera de los miembros de su propio grupo.[58][59]
"La historia evolutiva compartida de los seres humanos vivos ha resultado en una alta relación entre todas las personas vivas, como lo indica, por ejemplo, el índice de fijación muy bajo (FST) entre las poblaciones humanas vivas".
Richard Lewontin, quien afirmó estas proporciones, concluyó que ni la "raza" ni la "subespecie" eran formas apropiadas o útiles para describir las poblaciones humanas.[41]
El propio Wright creía que los valores> 0,25 representan una gran variación genética y que una FST de 0,15-0,25 representaba una gran variación. Sin embargo, alrededor del 5% de la variación humana ocurre entre poblaciones dentro de continentes, por lo tanto, en algunos estudios se han encontrado valores de FST entre grupos continentales de humanos (o razas) tan bajos como 0.1 (o posiblemente más bajos), lo que sugiere niveles más moderados de variación genética.[57] Se ha expresado que el FST no debe usarse como un marcador del estado de subespecies, ya que la estadística se usa para medir el grado de diferenciación entre poblaciones.[60]
Se ha criticado la aplicación de FST a poblaciones humanas, encontrando que la cifra del 85% es engañosa porque implica que todas las poblaciones humanas contienen en promedio el 85% de toda la diversidad genética. Argumentan que el modelo estadístico subyacente asume incorrectamente historias de variación iguales e independientes para cada gran población humana. Un enfoque más realista es comprender que algunos grupos humanos son parentales de otros grupos y que estos grupos representan grupos parafiléticos para sus grupos de ascendencia. Por ejemplo, según la reciente teoría del origen africano, la población humana en África es parafilética para todos los demás grupos humanos porque representa el grupo ancestral del que derivan todas las poblaciones no africanas, pero más que eso, los grupos no africanos solo derivan de una pequeña muestra no representativa de esta población africana. Esto significa que todos los grupos no africanos están más estrechamente relacionados entre sí y con algunos grupos africanos (probablemente africanos del este) que con otros, y además que la migración fuera de África representó un cuello de botella genético, con gran parte de la diversidad que existía en África no siendo sacado de África por los grupos emigrados. Bajo este escenario, las poblaciones humanas no tienen cantidades iguales de variabilidad local, sino cantidades de diversidad disminuidas cuanto más lejos de África vive una población. Se ha encontrado que en lugar del 85% de la diversidad genética humana existente en todas las poblaciones humanas, alrededor del 100% de la diversidad humana existe en una sola población africana, mientras que solo alrededor del 70% de la diversidad genética humana existe en una población derivada de Nueva Guinea. Se ha argumentado que esto todavía produce una población humana global que es genéticamente homogénea en comparación con otras poblaciones de mamíferos.[61]
Mezcla arcaica
[editar]Existe la hipótesis de que los humanos anatómicamente modernos se cruzaron con los neandertales durante el Paleolítico Medio. En mayo de 2010, el Proyecto del Genoma de Neandertal presentó evidencia genética de que el mestizaje probablemente tuvo lugar y que un pequeño pero significativa parte de la mezcla neandertal está presente en el ADN de los euroasiáticos y oceánicos modernos, y casi ausente en las poblaciones de África subsahariana.
Se cree que entre el 4% y el 6% del genoma de los melanesios (representado por Papúa Nueva Guinea y los isleños de Bougainville) deriva de homínidos de Denisova, una especie previamente desconocida que comparte un origen común con los neandertales. Posiblemente se introdujo durante la migración temprana de los antepasados de los melanesios al sudeste asiático. Esta historia de interacción sugiere que los denisovanos alguna vez se extendieron ampliamente por el este de Asia.[62]
Por lo tanto, los melanesios emergen como la población más arcaica mezclada, con una mezcla relacionada con Denisovan/Neanderthal de ~ 8%.[62]
En un estudio publicado en 2013, se estudió datos de secuencia completa del genoma y encontró tasas más altas de introgresión en asiáticos en comparación con los europeos.[63] Se probó la hipótesis de que los genomas africanos contemporáneos tienen firmas de flujo genético con ancestros humanos arcaicos y encontró evidencia de mezcla arcaica en genomas africanos, lo que sugiere que cantidades modestas de flujo genético se extendieron a lo largo del tiempo y el espacio durante la evolución de los humanos anatómicamente modernos.[64]
Categorización de la población mundial
[editar]
Los nuevos datos sobre la variación genética humana han reavivado el debate sobre una posible base biológica para la categorización de los humanos en razas. La mayor parte de la controversia gira en torno a la cuestión de cómo interpretar los datos genéticos y si las conclusiones basadas en ellos son sólidas. Algunos investigadores argumentan que la raza autoidentificada puede usarse como un indicador de ascendencia geográfica para ciertos riesgos de salud y medicamentos.
Aunque las diferencias genéticas entre los grupos humanos son relativamente pequeñas, estas diferencias en ciertos genes como duffy, ABCC11, SLC24A5, llamados marcadores informativos de ascendencia (AIM), sin embargo, pueden usarse para ubicar de manera confiable a muchos individuos dentro de agrupaciones geográficas amplias. Por ejemplo, los análisis informáticos de cientos de loci polimórficos muestreados en poblaciones distribuidas globalmente han revelado la existencia de agrupaciones genéticas que se asocian aproximadamente con grupos que históricamente han ocupado grandes regiones continentales y subcontinentales.
Algunos comentaristas han argumentado que estos patrones de variación proporcionan una justificación biológica para el uso de categorías raciales tradicionales. Argumentan que los agrupamientos continentales se corresponden aproximadamente con la división de los seres humanos en africanos subsaharianos; europeos, asiáticos occidentales, asiáticos centrales, asiáticos meridionales y africanos del norte; asiáticos del este, sudeste asiático, polinesios y nativos americanos; y otros habitantes de Oceanía (melanesios, micronesios y aborígenes australianos). Otros observadores no están de acuerdo, diciendo que los mismos datos socavan las nociones tradicionales de grupos raciales.[66] Señalan, por ejemplo, que las poblaciones principales consideradas razas o subgrupos dentro de las razas no forman necesariamente sus propios grupos.
Además, debido a que la variación genética humana es clinal, muchos individuos se afilian a dos o más grupos continentales. Por lo tanto, la "ascendencia biogeográfica" de base genética asignada a una persona determinada generalmente se distribuirá ampliamente y estará acompañada de incertidumbres considerables.
En muchas partes del mundo, los grupos se han mezclado de tal manera que muchos individuos tienen antepasados relativamente recientes de regiones muy separadas. Aunque los análisis genéticos de un gran número de loci pueden producir estimaciones del porcentaje de los antepasados de una persona que provienen de varias poblaciones continentales, estas estimaciones pueden asumir un carácter distintivo falso de las poblaciones parentales, ya que Los grupos humanos han intercambiado parejas de escalas locales a continentales a lo largo de la historia. Incluso con un gran número de marcadores, la información para estimar las proporciones de mezcla de individuos o grupos es limitada y las estimaciones suelen tener amplios intervalos de confianza.
Agrupación genética
[editar]Los datos genéticos se pueden utilizar para inferir la estructura de la población y asignar individuos a grupos que a menudo se corresponden con su ascendencia geográfica autoidentificada. Se ha argumentado que:
"...el análisis de muchos loci ahora produce estimaciones razonablemente precisas de similitud genética entre individuos, en lugar de poblaciones. La agrupación de individuos se correlaciona con el origen geográfico o la ascendencia".[10]
Sin embargo, la identificación por origen geográfico puede romperse rápidamente cuando se considera la ascendencia histórica compartida entre individuos en el tiempo.[67]
En 2009 se publicó un análisis de los datos de SNP autosómicos del Proyecto Internacional HapMap (Fase II) y del Panel de Diversidad del Genoma Humano del CEPH. El estudio de 53 poblaciones tomadas de los datos de HapMap y CEPH (1138 individuos no relacionados) sugirió que la selección natural puede dar forma al genoma humano mucho más lentamente de lo que se pensaba anteriormente, con factores como la migración dentro y entre continentes que influyen más fuertemente en la distribución de variaciones genéticas.[68] Un estudio similar publicado en 2010 encontró una fuerte evidencia de selección en todo el genoma debido a cambios en la ecorregión, la dieta y la subsistencia, particularmente en relación con las ecorregiones polares, con la búsqueda de alimento y con una dieta rica en raíces y tubérculos.[69] En un estudio de 2016, el análisis de componentes principales de datos de todo el genoma fue capaz de recuperar objetivos previamente conocidos para la selección positiva (sin una definición previa de poblaciones), así como una serie de nuevos genes candidatos.[70]
Antropología Forense
[editar]Los antropólogos forenses pueden determinar aspectos de la ascendencia geográfica (es decir, asiáticos, africanos o europeos) de restos óseos con un alto grado de precisión mediante el análisis de las medidas esqueléticas.[71] Según algunos estudios, los métodos de prueba individuales, como las mediciones de la mitad del rostro y los rasgos del fémur, pueden identificar la ascendencia geográfica y, por extensión, la categoría racial a la que se habría asignado a un individuo durante su vida, con más del 80% de precisión y en combinación puede ser incluso más precisa. Sin embargo, los esqueletos de personas que tienen ascendencia reciente en diferentes regiones geográficas pueden exhibir características de más de un grupo ancestral y, por lo tanto, no pueden identificarse como pertenecientes a un solo grupo ancestral.

Flujo y mezcla de genes
[editar]El flujo de genes entre dos poblaciones reduce la distancia genética promedio entre las poblaciones, solo las poblaciones humanas totalmente aisladas no experimentan flujo de genes y la mayoría de las poblaciones tienen un flujo de genes continuo con otras poblaciones vecinas que crean la distribución clinal observada para la variación genética de la polilla. Cuando el flujo de genes tiene lugar entre poblaciones genéticas bien diferenciadas, el resultado se denomina "mezcla genética".
El mapeo de mezclas es una técnica que se utiliza para estudiar cómo las variantes genéticas causan diferencias en las tasas de enfermedad entre la población.[72] Las poblaciones de mezclas recientes que rastrean su ascendencia a múltiples continentes son muy adecuadas para identificar genes de rasgos y enfermedades que difieren en la prevalencia entre las poblaciones parentales. Las poblaciones afroamericanas han sido el centro de numerosos estudios de mapeo genético y de mezclas de poblaciones, incluidos estudios de rasgos genéticos complejos como el recuento de glóbulos blancos, el índice de masa corporal, el cáncer de próstata y la enfermedad renal.[73]
Se llevó a cabo un análisis de la variación fenotípica y genética, incluido el color de la piel y el estado socioeconómico, en la población de Cabo Verde, que tiene una historia bien documentada de contacto entre europeos y africanos. Los estudios mostraron que el patrón de mezcla en esta población ha sido sesgado por el sexo y hay interacciones significativas entre el estatus socioeconómico y el color de la piel independientemente del color y la ascendencia de la piel.[74] Otro estudio muestra un mayor riesgo de complicaciones de la enfermedad de injerto contra huésped después del trasplante debido a variantes genéticas en el antígeno leucocitario humano (HLA) y las proteínas no HLA.[75]
Salud
[editar]Las diferencias en la frecuencia de los alelos contribuyen a diferencias de grupo en la incidencia de algunas enfermedades monogénicas y pueden contribuir a diferencias en la incidencia de algunas enfermedades comunes.[76] Para las enfermedades monogénicas, la frecuencia de los alelos causales generalmente se correlaciona mejor con la ascendencia, ya sea familiar (por ejemplo, síndrome de Ellis-van Creveld entre los amish de Pensilvania) o étnica, enfermedad de Tay-Sachs entre las poblaciones judías asquenazíes) o geográfica (hemoglobinopatías entre personas con antepasados que vivieron en regiones palúdicas). En la medida en que la ascendencia se corresponda con grupos o subgrupos raciales o étnicos, la incidencia de enfermedades monogénicas puede diferir entre los grupos categorizados por raza o etnia, y los profesionales de la salud suelen tener en cuenta estos patrones al realizar diagnósticos.[77]
Incluso con enfermedades comunes que involucran numerosas variantes genéticas y factores ambientales, los investigadores señalan evidencia que sugiere la participación de alelos distribuidos diferencialmente con efectos pequeños a moderados. Los ejemplos citados con frecuencia incluyen hipertensión, diabetes, obesidad y cáncer de próstata. Sin embargo, en ninguno de estos casos se ha demostrado que la variación alélica en un gen de susceptibilidad explica una fracción significativa de la diferencia en la prevalencia de la enfermedad entre los grupos, y el papel de los factores genéticos en la generación de estas diferencias sigue siendo incierto.
Algunas otras variaciones, por otro lado, son beneficiosas para los humanos, ya que previenen ciertas enfermedades y aumentan la posibilidad de adaptarse al medio ambiente. Por ejemplo, mutación en el gen CCR5 que protege contra el SIDA. El gen CCR5 está ausente en la superficie de la célula debido a una mutación. Sin el gen CCR5 en la superficie, no hay nada a lo que los virus del VIH se adhieran y se unan. Por lo tanto, la mutación en el gen CCR5 disminuye la posibilidad de que una persona corra el riesgo de padecer SIDA. La mutación en CCR5 también es bastante popular en ciertas áreas, con más del 14% de la población portadora de la mutación en Europa y alrededor del 6-10% en Asia y África del Norte.[78]

Aparte de las mutaciones, muchos genes que pueden haber ayudado a los humanos en la antigüedad afectan a los humanos en la actualidad. Por ejemplo, se sospecha que los genes que permiten a los humanos procesar los alimentos de manera más eficiente son los que hacen que las personas sean susceptibles a la obesidad y la diabetes en la actualidad.[79]
Neil Risch de la Universidad de Stanford ha propuesto que la raza/grupo étnico autoidentificado podría ser un medio válido de categorización en los EE. UU. para consideraciones de salud pública y políticas.[80][76] Un artículo de 2002 del grupo de Noah Rosenberg hace una afirmación similar:
La estructura de las poblaciones humanas es relevante en varios contextos epidemiológicos. Como resultado de la variación en la frecuencia de factores de riesgo tanto genéticos como no genéticos, las tasas de enfermedad y de fenotipos como la respuesta adversa al fármaco varían entre las poblaciones. Además, la información sobre la población de origen de un paciente podría proporcionar a los profesionales de la salud información sobre el riesgo cuando se desconocen las causas directas de la enfermedad.[81]
Sin embargo, en 2018 Noah Rosenberg publicó un estudio que argumentaba en contra de las ideas genéticamente esencialistas de las disparidades de salud entre las poblaciones, afirmando que las variantes ambientales son una causa más probable Interpretación de puntajes poligénicos, adaptación poligénica y diferencias fenotípicas humanas
Proyectos de genoma
[editar]Los proyectos del genoma humano son esfuerzos científicos que determinan o estudian la estructura del genoma humano. El Proyecto Genoma Humano fue un proyecto genómico histórico.
Véase también
[editar]- Raza y genética
- Arqueogenética
- Genética evolutiva humana
- Hipótesis multirregional
- Hipótesis reciente de origen único
- Aislamiento por distancia
- Prueba de ADN genealógica
- Haplogrupos del cromosoma Y en poblaciones del mundo
- Agrupación genética humana
- Neurodiversidad
Regional:
- Historia genética de Europa
- Historia genética del sur de Asia
- Mezcla africana en Europa
- Historia genética de los pueblos indígenas de las Américas
- Historia genética de las Islas Británicas
Proyectos:
Referencias
[editar]- ↑ Bruder, Carl E.G.; Piotrowski, Arkadiusz; Gijsbers, Antoinet A.C.J.; Andersson, Robin; Erickson, Stephen; Diaz de Ståhl, Teresita; Menzel, Uwe; Sandgren, Johanna et al. (2008-03). «Phenotypically Concordant and Discordant Monozygotic Twins Display Different DNA Copy-Number-Variation Profiles». The American Journal of Human Genetics 82 (3): 763-771. ISSN 0002-9297. PMC 2427204. PMID 18304490. doi:10.1016/j.ajhg.2007.12.011.
- ↑ a b NCBI (8 de mayo de 2017). «dbSNP's human build 150 has doubled the amount of RefSNP records!». NCBI Insights. Consultado el 16 de mayo de 2017.
- ↑ a b c d Auton, Adam; Abecasis, Gonçalo R.; Altshuler, David M.; Durbin, Richard M.; Abecasis, Gonçalo R.; Bentley, David R.; Chakravarti, Aravinda; Clark, Andrew G. et al. (2015-10). «A global reference for human genetic variation». Nature (en inglés) 526 (7571): 68-74. ISSN 1476-4687. PMC 4750478. PMID 26432245. doi:10.1038/nature15393.
- ↑ «We are all mutants: First direct whole-genome measure of human mutation predicts 60 new mutations in each of us». Science Daily. 13 de junio de 2011. Consultado el 5 de septiembre de 2011.
- ↑ Conrad, Donald F; Keebler, Jonathan E M; DePristo, Mark A; Lindsay, Sarah J; Zhang, Yujun; Casals, Ferran; Idaghdour, Youssef; Hartl, Chris L et al. (2011-07). «Variation in genome-wide mutation rates within and between human families». Nature Genetics (en inglés) 43 (7): 712-714. ISSN 1546-1718. PMC 3322360. PMID 21666693. doi:10.1038/ng.862.
- ↑ Guo, Jing; Wu, Yang; Zhu, Zhihong; Zheng, Zhili; Trzaskowski, Maciej; Zeng, Jian; Robinson, Matthew R.; Visscher, Peter M. et al. (14 de mayo de 2018). «Global genetic differentiation of complex traits shaped by natural selection in humans». Nature Communications (en inglés) 9 (1): 1865. ISSN 2041-1723. PMC 5951811. PMID 29760457. doi:10.1038/s41467-018-04191-y.
- ↑ Wang, E. T.; Kodama, G.; Baldi, P.; Moyzis, R. K. (21 de diciembre de 2005). «Global landscape of recent inferred Darwinian selection for Homo sapiens». Proceedings of the National Academy of Sciences (en inglés) 103 (1): 135-140. ISSN 0027-8424. PMC 1317879. PMID 16371466. doi:10.1073/pnas.0509691102.
- ↑ Kidd, Jeffrey M.; Cooper, Gregory M.; Donahue, William F.; Hayden, Hillary S.; Sampas, Nick; Graves, Tina; Hansen, Nancy; Teague, Brian et al. (2008-05). «Mapping and sequencing of structural variation from eight human genomes». Nature (en inglés) 453 (7191): 56-64. ISSN 1476-4687. PMC 2424287. PMID 18451855. doi:10.1038/nature06862. Consultado el 4 de septiembre de 2020.
- ↑ Driscoll, Deborah A.; Gross, Susan (11 de junio de 2009). «Prenatal Screening for Aneuploidy». New England Journal of Medicine 360 (24): 2556-2562. ISSN 0028-4793. PMID 19516035. doi:10.1056/NEJMcp0900134.
- ↑ a b Jorde, Lynn B.; Wooding, Stephen P. (2004-11). «Genetic variation, classification and 'race'». Nature Genetics 36 (11 Suppl): S28-33. ISSN 1061-4036. PMID 15508000. doi:10.1038/ng1435.
- ↑ Tishkoff, Sarah A.; Kidd, Kenneth K. (2004-11). «Implications of biogeography of human populations for 'race' and medicine». Nature Genetics (en inglés) 36 (11): S21-S27. ISSN 1546-1718. doi:10.1038/ng1438.
- ↑ Mullaney, Julienne M.; Mills, Ryan E.; Pittard, W. Stephen; Devine, Scott E. (15 de octubre de 2010). «Small insertions and deletions (INDELs) in human genomes». Human Molecular Genetics (en inglés) 19 (R2): R131-R136. ISSN 0964-6906. PMC 2953750. PMID 20858594. doi:10.1093/hmg/ddq400.
- ↑ a b Collins, Francis S.; Brooks, Lisa D.; Chakravarti, Aravinda (1 de diciembre de 1998). «A DNA Polymorphism Discovery Resource for Research on Human Genetic Variation». Genome Research (en inglés) 8 (12): 1229-1231. ISSN 1088-9051. PMID 9872978. doi:10.1101/gr.8.12.1229.
- ↑ Thomas, Philippe E.; Klinger, Roman; Furlong, Laura I.; Hofmann-Apitius, Martin; Friedrich, Christoph M. (5 de julio de 2011). «Challenges in the association of human single nucleotide polymorphism mentions with unique database identifiers». BMC Bioinformatics 12 (4): S4. ISSN 1471-2105. PMC 3194196. PMID 21992066. doi:10.1186/1471-2105-12-S4-S4.
- ↑ Ke, Xiayi; Taylor, Martin S.; Cardon, Lon R. (2008-04). «Singleton SNPs in the human genome and implications for genome-wide association studies». European Journal of Human Genetics (en inglés) 16 (4): 506-515. ISSN 1476-5438. doi:10.1038/sj.ejhg.5201987.
- ↑ Schork, Nicholas J, ed. (August 2008). «Genetic variation in an individual human exome». PLoS Genetics 4 (8): e1000160. PMC 2493042. PMID 18704161. doi:10.1371/journal.pgen.1000160.
- ↑ Gross, Liza (4 de septiembre de 2007). «A New Human Genome Sequence Paves the Way for Individualized Genomics». PLOS Biology (en inglés) 5 (10): e266. ISSN 1545-7885. PMC 1964778. PMID 20076646. doi:10.1371/journal.pbio.0050266.
- ↑ «First Individual Diploid Human Genome Published By Researchers at J. Craig Venter Institute». J. Craig Venter Institute. 3 de septiembre de 2007. Archivado desde el original el 16 de julio de 2011. Consultado el 5 de septiembre de 2011.
- ↑ Levy, Samuel; Sutton, Granger; Ng, Pauline C.; Feuk, Lars; Halpern, Aaron L.; Walenz, Brian P.; Axelrod, Nelson; Huang, Jiaqi et al. (4 de septiembre de 2007). «The diploid genome sequence of an individual human». PLoS biology 5 (10): e254. ISSN 1545-7885. PMC 1964779. PMID 17803354. doi:10.1371/journal.pbio.0050254.
- ↑ «Understanding Genetics: Human Health and the Genome». The Tech Museum of Innovation. 24 de enero de 2008. Archivado desde el original el 29 de abril de 2012. Consultado el 5 de septiembre de 2011.
- ↑ «First Diploid Human Genome Sequence Shows We're Surprisingly Different». Science Daily. 4 de septiembre de 2007. Consultado el 5 de septiembre de 2011.
- ↑ «Copy number variation may stem from replication misstep». EurekAlert!. 27 de diciembre de 2007. Consultado el 5 de septiembre de 2011.
- ↑ Lee, Jennifer A.; Carvalho, Claudia M. B.; Lupski, James R. (28 de diciembre de 2007). «A DNA replication mechanism for generating nonrecurrent rearrangements associated with genomic disorders». Cell 131 (7): 1235-1247. ISSN 0092-8674. PMID 18160035. doi:10.1016/j.cell.2007.11.037.
- ↑ Redon, Richard; Ishikawa, Shumpei; Fitch, Karen R.; Feuk, Lars; Perry, George H.; Andrews, T. Daniel; Fiegler, Heike; Shapero, Michael H. et al. (23 de noviembre de 2006). «Global variation in copy number in the human genome». Nature 444 (7118): 444-454. ISSN 1476-4687. PMC 2669898. PMID 17122850. doi:10.1038/nature05329.
- ↑ Dumas, Laura; Kim, Young H.; Karimpour-Fard, Anis; Cox, Michael; Hopkins, Janet; Pollack, Jonathan R.; Sikela, James M. (2007-09). «Gene copy number variation spanning 60 million years of human and primate evolution». Genome Research 17 (9): 1266-1277. ISSN 1088-9051. PMC 1950895. PMID 17666543. doi:10.1101/gr.6557307.
- ↑ Prüfer, Kay; Racimo, Fernando; Patterson, Nick; Jay, Flora; Sankararaman, Sriram; Sawyer, Susanna; Heinze, Anja; Renaud, Gabriel et al. (2 de enero de 2014). «The complete genome sequence of a Neanderthal from the Altai Mountains». Nature 505 (7481): 43-49. ISSN 1476-4687. PMC 4031459. PMID 24352235. doi:10.1038/nature12886.
- ↑ Pratas, Diogo; Hosseini, Morteza; Silva, Raquel M.; Pinho, Armando J.; Ferreira, Paulo J. S. G. (2017). «Visualization of Distinct DNA Regions of the Modern Human Relatively to a Neanderthal Genome». En Alexandre, Luís A., ed. Pattern Recognition and Image Analysis. Lecture Notes in Computer Science (en inglés) (Springer International Publishing): 235-242. ISBN 978-3-319-58838-4. doi:10.1007/978-3-319-58838-4_26.
- ↑ «Human Genetic Variation Fact Sheet». National Institute of General Medical Sciences. 19 de agosto de 2011. Archivado desde el original el 16 de septiembre de 2008. Consultado el 5 de septiembre de 2011.
- ↑ Rakyan, Vardhman; Whitelaw, Emma (8 de enero de 2003). «Transgenerational epigenetic inheritance». Current biology: CB 13 (1): R6. ISSN 0960-9822. PMID 12526754. doi:10.1016/s0960-9822(02)01377-5.
- ↑ King, Robert C.; Mulligan, Pamela Khipple (2006). A dictionary of genetics (7th ed edición). Oxford University Press. ISBN 978-1-4294-4025-7. OCLC 79595687.
- ↑ Begon, Michael; Harper, John L. (2006). Ecology : from individuals to ecosystems (en inglés) (Fourth edition edición). p. 10. ISBN 978-1-4051-1117-1. OCLC 57675855.
- ↑ «Haplogroup». DNA-Newbie Glossary. International Society of Genetic Genealogy. Consultado el 5 de septiembre de 2012.
- ↑ «The descent of man Chapter 6 – On the Affinities and Genealogy of Man». Darwin-online.org.uk. Consultado el 11 de enero de 2011. «En cada gran región del mundo, los mamíferos vivos están estrechamente relacionados con las especies extintas de la misma región. Por lo tanto, es probable que África estuviera antiguamente habitada por simios extintos estrechamente aliados del gorila y el chimpancé; y como estas dos especies son ahora los aliados más cercanos del hombre, es algo más probable que nuestros primeros progenitores vivieran en el continente africano que en cualquier otro lugar. Pero es inútil especular sobre este tema, ya que un simio casi tan grande como un hombre, a saber, el Dryopithecus de Lartet, que estaba estrechamente relacionado con los antropomorfos Hylobates, existió en Europa durante el período del Mioceno superior; y desde un período tan remoto, la tierra ciertamente ha experimentado muchas grandes revoluciones, y ha habido tiempo suficiente para la migración en la mayor escala.»
- ↑ Underhill, P. A.; Shen, P.; Lin, A. A.; Jin, L.; Passarino, G.; Yang, W. H.; Kauffman, E.; Bonné-Tamir, B. et al. (2000-11). «Y chromosome sequence variation and the history of human populations». Nature Genetics 26 (3): 358-361. ISSN 1061-4036. PMID 11062480. doi:10.1038/81685.
- ↑ a b «New Research Proves Single Origin Of Humans In Africa». Science Daily. 19 de julio de 2007. Consultado el 5 de septiembre de 2011.
- ↑ Manica, Andrea; Amos, Bill; Balloux, François; Hanihara, Tsunehiko (19 de julio de 2007). «The effect of ancient population bottlenecks on human phenotypic variation». Nature 448 (7151): 346-348. ISSN 0028-0836. PMC 1978547. PMID 17637668. doi:10.1038/nature05951.
- ↑ Tishkoff, Sarah A.; Reed, Floyd A.; Friedlaender, Françoise R.; Ehret, Christopher; Ranciaro, Alessia; Froment, Alain; Hirbo, Jibril B.; Awomoyi, Agnes A. et al. (22 de mayo de 2009). «The genetic structure and history of Africans and African Americans». Science (New York, N.Y.) 324 (5930): 1035-1044. ISSN 1095-9203. PMC 2947357. PMID 19407144. doi:10.1126/science.1172257.
- ↑ Schlebusch, Carina M.; Jakobsson, Mattias (31 de agosto de 2018). «Tales of Human Migration, Admixture, and Selection in Africa». Annual Review of Genomics and Human Genetics 19: 405-428. ISSN 1545-293X. PMID 29727585. doi:10.1146/annurev-genom-083117-021759.
- ↑ 1000 Genomes Project Consortium; Auton, Adam; Brooks, Lisa D.; Durbin, Richard M.; Garrison, Erik P.; Kang, Hyun Min; Korbel, Jan O.; Marchini, Jonathan L. et al. (1 de octubre de 2015). «A global reference for human genetic variation». Nature 526 (7571): 68-74. ISSN 1476-4687. PMC 4750478. PMID 26432245. doi:10.1038/nature15393.
- ↑ Gabriel, Stacey B.; Schaffner, Stephen F.; Nguyen, Huy; Moore, Jamie M.; Roy, Jessica; Blumenstiel, Brendan; Higgins, John; DeFelice, Matthew et al. (21 de junio de 2002). «The structure of haplotype blocks in the human genome». Science (New York, N.Y.) 296 (5576): 2225-2229. ISSN 1095-9203. PMID 12029063. doi:10.1126/science.1069424.
- ↑ a b Lewontin, R. C. (1972). Dobzhansky, Theodosius, ed. Evolutionary Biology: Volume 6 (en inglés). Springer US. pp. 381-398. ISBN 978-1-4684-9063-3. doi:10.1007/978-1-4684-9063-3_14.
- ↑ Bamshad, Michael J.; Wooding, Stephen; Watkins, W. Scott; Ostler, Christopher T.; Batzer, Mark A.; Jorde, Lynn B. (2003-3). «Human Population Genetic Structure and Inference of Group Membership». American Journal of Human Genetics 72 (3): 578-589. ISSN 0002-9297. PMC 1180234. PMID 12557124.
- ↑ Manica, Andrea; Amos, William; Balloux, François; Hanihara, Tsunehiko (2007-07). «The effect of ancient population bottlenecks on human phenotypic variation». Nature (en inglés) 448 (7151): 346-348. ISSN 0028-0836. doi:10.1038/nature05951.
- ↑ Keita, S. O. Y.; Kittles, Rick A. (1997). «The Persistence of Racial Thinking and the Myth of Racial Divergence». American Anthropologist (en inglés) 99 (3): 534-544. ISSN 1548-1433. doi:10.1525/aa.1997.99.3.534.
- ↑ Relethford, John H. (2002). «Apportionment of global human genetic diversity based on craniometrics and skin color». American Journal of Physical Anthropology (en inglés) 118 (4): 393-398. ISSN 1096-8644. doi:10.1002/ajpa.10079.
- ↑ Jablonski, Nina G. (10 de enero de 2014). «The Biological and Social Meaning of Skin Color». Living Color: The Biological and Social Meaning of Skin Color. University of California Press. ISBN 978-0-520-28386-2. Resumen divulgativo (12 July 2015).
- ↑ Grubert, Fabian; Zaugg, Judith B.; Kasowski, Maya; Ursu, Oana; Spacek, Damek V.; Martin, Alicia R.; Greenside, Peyton; Srivas, Rohith et al. (27 de agosto de 2015). «Genetic Control of Chromatin States in Humans Involves Local and Distal Chromosomal Interactions». Cell 162 (5): 1051-1065. ISSN 0092-8674. PMC 4556133. PMID 26300125. doi:10.1016/j.cell.2015.07.048.
- ↑ Cenik, Can; Cenik, Elif Sarinay; Byeon, Gun W.; Grubert, Fabian; Candille, Sophie I.; Spacek, Damek; Alsallakh, Bilal; Tilgner, Hagen et al. (2015-11). «Integrative analysis of RNA, translation, and protein levels reveals distinct regulatory variation across humans». Genome Research 25 (11): 1610-1621. ISSN 1549-5469. PMC 4617958. PMID 26297486. doi:10.1101/gr.193342.115.
- ↑ Wu, Linfeng; Candille, Sophie I.; Choi, Yoonha; Xie, Dan; Jiang, Lihua; Li-Pook-Than, Jennifer; Tang, Hua; Snyder, Michael (4 de julio de 2013). «Variation and genetic control of protein abundance in humans». Nature 499 (7456): 79-82. ISSN 1476-4687. PMC 3789121. PMID 23676674. doi:10.1038/nature12223.
- ↑ «Ethnicity tied to gene expression». The Scientist. 9 de enero de 2007. Archivado desde el original el 8 de mayo de 2015. Consultado el 5 de septiembre de 2011.
- ↑ Spielman, Richard S; Bastone, Laurel A; Burdick, Joshua T; Morley, Michael; Ewens, Warren J; Cheung, Vivian G (2007-2). «Common genetic variants account for differences in gene expression among ethnic groups». Nature genetics 39 (2): 226-231. ISSN 1061-4036. PMC 3005333. PMID 17206142. doi:10.1038/ng1955.
- ↑ «Ethnic Differences Traced to Variable Gene Expression». Scientific American. 9 de enero de 2007. Consultado el 5 de septiembre de 2011.
- ↑ Check, Erika (7 de enero de 2007). «Genetic expression speaks as loudly as gene type». Nature (en inglés): news070101-8. ISSN 0028-0836. doi:10.1038/news070101-8.
- ↑ «Variable gene expression seen in different ethnic groups». BioNews.org. 15 de enero de 2007. Archivado desde el original el 26 de marzo de 2016. Consultado el 5 de septiembre de 2011.
- ↑ «Differences of gene expression between human populations». Anthropology.net. 28 de febrero de 2008. Archivado desde el original el 30 de septiembre de 2011. Consultado el 5 de septiembre de 2011.
- ↑ «Gene-expression variation within and among human populations». American Journal of Human Genetics 80 (3): 502-9. March 2007. PMC 1821107. PMID 17273971. doi:10.1086/512017.
- ↑ a b Graves, Joseph L. (2006). «What We Know and What We Don't Know: Human Genetic Variation and the Social Construction of Race». Is Race "Real"?. Social Science Research Council. Consultado el 22 de enero de 2011.
- ↑ Keita, S. O. Y.; Kittles, R. A.; Royal, C. D. M.; Bonney, G. E.; Furbert-Harris, P.; Dunston, G. M.; Rotimi, C. N. (2004-11). «Conceptualizing human variation». Nature Genetics 36 (11 Suppl): S17-20. ISSN 1061-4036. PMID 15507998. doi:10.1038/ng1455.
- ↑ Hawks, John (2013). Significance of Neandertal and Denisovan Genomes in Human Evolution 42. Annual Reviews. pp. 433-49. ISBN 978-0-8243-1942-7. doi:10.1146/annurev-anthro-092412-155548.
- ↑ Wright, Sewall (1978). Evolution and the Genetics of Populations. 4, Variability Within and Among Natural Populations. Chicago, Illinois: Univ. Chicago Press. p. 438.
- ↑ Long, Jeffrey C.; Kittles, Rick A. (2003-08). «Human genetic diversity and the nonexistence of biological races». Human Biology 75 (4): 449-471. ISSN 0018-7143. PMID 14655871. doi:10.1353/hub.2003.0058.
- ↑ a b Reich, David; Green, Richard E.; Kircher, Martin; Krause, Johannes; Patterson, Nick; Durand, Eric Y.; Viola, Bence; Briggs, Adrian W. et al. (23 de diciembre de 2010). «Genetic history of an archaic hominin group from Denisova Cave in Siberia». Nature 468 (7327): 1053-1060. ISSN 1476-4687. PMC 4306417. PMID 21179161. doi:10.1038/nature09710.
- ↑ Wall, Jeffrey D.; Yang, Melinda A.; Jay, Flora; Kim, Sung K.; Durand, Eric Y.; Stevison, Laurie S.; Gignoux, Christopher; Woerner, August et al. (2013-05). «Higher levels of neanderthal ancestry in East Asians than in Europeans». Genetics 194 (1): 199-209. ISSN 1943-2631. PMC 3632468. PMID 23410836. doi:10.1534/genetics.112.148213.
- ↑ Hammer, Michael F.; Woerner, August E.; Mendez, Fernando L.; Watkins, Joseph C.; Wall, Jeffrey D. (13 de septiembre de 2011). «Genetic evidence for archaic admixture in Africa». Proceedings of the National Academy of Sciences of the United States of America 108 (37): 15123-15128. ISSN 0027-8424. PMC 3174671. PMID 21896735. doi:10.1073/pnas.1109300108.
- ↑ «Low levels of genetic divergence across geographically and linguistically diverse populations from India». PLoS Genetics 2 (12): e215. December 2006. PMC 1713257. PMID 17194221. doi:10.1371/journal.pgen.0020215.
- ↑ Tishkoff, Sarah A.; Kidd, Kenneth K. (2004-11). «Implications of biogeography of human populations for 'race' and medicine». Nature Genetics 36 (11 Suppl): S21-27. ISSN 1061-4036. PMID 15507999. doi:10.1038/ng1438.
- ↑ Albers, Patrick K.; McVean, Gil (13 de septiembre de 2018). «Dating genomic variants and shared ancestry in population-scale sequencing data». bioRxiv (en inglés): 416610. doi:10.1101/416610.
- ↑ Coop, Graham; Pickrell, Joseph K.; Novembre, John; Kudaravalli, Sridhar; Li, Jun; Absher, Devin; Myers, Richard M.; Cavalli-Sforza, Luigi Luca et al. (5 de junio de 2009). «The Role of Geography in Human Adaptation». PLoS Genetics 5 (6). ISSN 1553-7390. PMC 2685456. PMID 19503611. doi:10.1371/journal.pgen.1000500.
- ↑ Hancock, Angela M.; Witonsky, David B.; Ehler, Edvard; Alkorta-Aranburu, Gorka; Beall, Cynthia; Gebremedhin, Amha; Sukernik, Rem; Utermann, Gerd et al. (11 de mayo de 2010). «Colloquium paper: human adaptations to diet, subsistence, and ecoregion are due to subtle shifts in allele frequency». Proceedings of the National Academy of Sciences of the United States of America. 107 Suppl 2: 8924-8930. ISSN 1091-6490. PMC 3024024. PMID 20445095. doi:10.1073/pnas.0914625107.
- ↑ Duforet-Frebourg, Nicolas; Luu, Keurcien; Laval, Guillaume; Bazin, Eric; Blum, Michael G. B. (2016-04). «Detecting Genomic Signatures of Natural Selection with Principal Component Analysis: Application to the 1000 Genomes Data». Molecular Biology and Evolution 33 (4): 1082-1093. ISSN 1537-1719. PMC 4776707. PMID 26715629. doi:10.1093/molbev/msv334.
- ↑ «Does Race Exist?». NOVA. PBS. 15 de febrero de 2000. Consultado el 5 de septiembre de 2011.
- ↑ Winkler, Cheryl A.; Nelson, George W.; Smith, Michael W. (2010). «Admixture mapping comes of age». Annual Review of Genomics and Human Genetics 11: 65-89. ISSN 1545-293X. PMC 7454031. PMID 20594047. doi:10.1146/annurev-genom-082509-141523.
- ↑ Bryc, Katarzyna; Auton, Adam; Nelson, Matthew R.; Oksenberg, Jorge R.; Hauser, Stephen L.; Williams, Scott; Froment, Alain; Bodo, Jean-Marie et al. (12 de enero de 2010). «Genome-wide patterns of population structure and admixture in West Africans and African Americans». Proceedings of the National Academy of Sciences of the United States of America 107 (2): 786-791. ISSN 0027-8424. PMC 2818934. PMID 20080753. doi:10.1073/pnas.0909559107.
- ↑ Beleza, Sandra; Campos, Joana; Lopes, Jailson; Araújo, Isabel Inês; Hoppfer Almada, Ana; Correia e Silva, António; Parra, Esteban J.; Rocha, Jorge (2012). «The admixture structure and genetic variation of the archipelago of Cape Verde and its implications for admixture mapping studies». PloS One 7 (11): e51103. ISSN 1932-6203. PMC 3511383. PMID 23226471. doi:10.1371/journal.pone.0051103.
- ↑ Arrieta-Bolaños, Esteban; Madrigal, J. Alejandro; Shaw, Bronwen E. (2012). «Human leukocyte antigen profiles of latin american populations: differential admixture and its potential impact on hematopoietic stem cell transplantation». Bone Marrow Research 2012: 136087. ISSN 2090-3006. PMC 3506882. PMID 23213535. doi:10.1155/2012/136087.
- ↑ a b Risch, Neil; Burchard, Esteban; Ziv, Elad; Tang, Hua (1 de julio de 2002). «Categorization of humans in biomedical research: genes, race and disease». Genome Biology 3 (7): comment2007. ISSN 1474-760X. PMID 12184798. doi:10.1186/gb-2002-3-7-comment2007.
- ↑ Lu, Yi-Fan; Goldstein, David B.; Angrist, Misha; Cavalleri, Gianpiero (24 de julio de 2014). «Personalized medicine and human genetic diversity». Cold Spring Harbor Perspectives in Medicine 4 (9): a008581. ISSN 2157-1422. PMC 4143101. PMID 25059740. doi:10.1101/cshperspect.a008581.
- ↑ Limborska, Svetlana A.; Balanovsky, Oleg P.; Balanovskaya, Elena V.; Slominsky, Peter A.; Schadrina, Maria I.; Livshits, Ludmila A.; Kravchenko, Sergey A.; Pampuha, Vladimir M. et al. (2002). «Analysis of CCR5Delta32 geographic distribution and its correlation with some climatic and geographic factors». Human Heredity 53 (1): 49-54. ISSN 0001-5652. PMID 11901272. doi:10.1159/000048605.
- ↑ Tishkoff, Sarah A.; Verrelli, Brian C. (2003). «Patterns of human genetic diversity: implications for human evolutionary history and disease». Annual Review of Genomics and Human Genetics 4: 293-340. ISSN 1527-8204. PMID 14527305. doi:10.1146/annurev.genom.4.070802.110226.
- ↑ Tang, Hua; Quertermous, Tom; Rodriguez, Beatriz; Kardia, Sharon L. R.; Zhu, Xiaofeng; Brown, Andrew; Pankow, James S.; Province, Michael A. et al. (2005-2). «Genetic Structure, Self-Identified Race/Ethnicity, and Confounding in Case-Control Association Studies». American Journal of Human Genetics 76 (2): 268-275. ISSN 0002-9297. PMC 1196372. PMID 15625622.
- ↑ Rosenberg, Noah A.; Pritchard, Jonathan K.; Weber, James L.; Cann, Howard M.; Kidd, Kenneth K.; Zhivotovsky, Lev A.; Feldman, Marcus W. (20 de diciembre de 2002). «Genetic structure of human populations». Science (New York, N.Y.) 298 (5602): 2381-2385. ISSN 1095-9203. PMID 12493913. doi:10.1126/science.1078311.
Otras lecturas
[editar]- Race, Ethnicity (October 2005). «The use of racial, ethnic, and ancestral categories in human genetics research». American Journal of Human Genetics 77 (4): 519-32. PMC 1275602. PMID 16175499. doi:10.1086/491747.
- Altmüller J, Palmer LJ, Fischer G, Scherb H, Wjst M (November 2001). «Genomewide scans of complex human diseases: true linkage is hard to find». American Journal of Human Genetics 69 (5): 936-50. PMC 1274370. PMID 11565063. doi:10.1086/324069.
- Aoki K (2002). «Sexual selection as a cause of human skin colour variation: Darwin's hypothesis revisited». Annals of Human Biology 29 (6): 589-608. PMID 12573076. doi:10.1080/0301446021000019144.
- Bamshad M, Wooding S, Salisbury BA, Stephens JC (August 2004). «Deconstructing the relationship between genetics and race». Nature Reviews. Genetics 5 (8): 598-609. PMID 15266342. doi:10.1038/nrg1401. reprint-zip
- Bamshad M, Wooding SP (February 2003). «Signatures of natural selection in the human genome». Nature Reviews. Genetics 4 (2): 99-111. PMID 12560807. doi:10.1038/nrg999.
- Cann RL, Stoneking M, Wilson AC (1987). «Mitochondrial DNA and human evolution». Nature 325 (6099): 31-36. Bibcode:1987Natur.325...31C. PMID 3025745. doi:10.1038/325031a0.
- Cardon LR, Abecasis GR (March 2003). «Using haplotype blocks to map human complex trait loci». Trends in Genetics 19 (3): 135-40. PMID 12615007. doi:10.1016/S0168-9525(03)00022-2.
- Cavalli-Sforza LL, Feldman MW (March 2003). «The application of molecular genetic approaches to the study of human evolution». Nature Genetics. 33 Suppl (3s): 266-75. PMID 12610536. doi:10.1038/ng1113.
- Collins FS (November 2004). «What we do and don't know about 'race', 'ethnicity', genetics and health at the dawn of the genome era». Nature Genetics 36 (11 Suppl): S13-15. PMID 15507997. doi:10.1038/ng1436.
- Collins FS, Green ED, Guttmacher AE, Guyer MS (April 2003). «A vision for the future of genomics research». Nature 422 (6934): 835-47. Bibcode:2003Natur.422..835C. PMID 12695777. doi:10.1038/nature01626.
- Ebersberger I, Metzler D, Schwarz C, Pääbo S (June 2002). «Genomewide comparison of DNA sequences between humans and chimpanzees». American Journal of Human Genetics 70 (6): 1490-97. PMC 379137. PMID 11992255. doi:10.1086/340787.
- Edwards AW (August 2003). «Human genetic diversity: Lewontin's fallacy». BioEssays 25 (8): 798-801. PMID 12879450. doi:10.1002/bies.10315.
- Foster MW, Sharp RR (October 2004). «Beyond race: towards a whole-genome perspective on human populations and genetic variation». Nature Reviews. Genetics 5 (10): 790-96. PMID 15510170. doi:10.1038/nrg1452.
- Foster MW, Sharp RR, Freeman WL, Chino M, Bernsten D, Carter TH (June 1999). «The role of community review in evaluating the risks of human genetic variation research». American Journal of Human Genetics 64 (6): 1719-27. PMC 1377916. PMID 10330360. doi:10.1086/302415.
- Gabriel SB, Schaffner SF, Nguyen H, Moore JM, Roy J, Blumenstiel B, Higgins J, DeFelice M, Lochner A, Faggart M, Liu-Cordero SN, Rotimi C, Adeyemo A, Cooper R, Ward R, Lander ES, Daly MJ, Altshuler D (June 2002). «The structure of haplotype blocks in the human genome». Science 296 (5576): 2225-29. Bibcode:2002Sci...296.2225G. PMID 12029063. doi:10.1126/science.1069424.
- Harding RM, Healy E, Ray AJ, Ellis NS, Flanagan N, Todd C, Dixon C, Sajantila A, Jackson IJ, Birch-Machin MA, Rees JL (April 2000). «Evidence for variable selective pressures at MC1R». American Journal of Human Genetics 66 (4): 1351-61. PMC 1288200. PMID 10733465. doi:10.1086/302863.
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (December 2000). «Mitochondrial genome variation and the origin of modern humans». Nature 408 (6813): 708-13. Bibcode:2000Natur.408..708I. PMID 11130070. doi:10.1038/35047064.
- The International Hapmap Consortium (December 2003). «The International HapMap Project». Nature 426 (6968): 789-96. Bibcode:2003Natur.426..789G. PMID 14685227. doi:10.1038/nature02168.
- The International Hapmap Consortium (June 2004). «Integrating ethics and science in the International HapMap Project». Nature Reviews. Genetics 5 (6): 467-75. PMC 2271136. PMID 15153999. doi:10.1038/nrg1351.
- Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W, Funke R, Gage D, Harris K, Heaford A, Howland J, Kann L, Lehoczky J, LeVine R, McEwan P, McKernan K, Meldrim J, Mesirov JP, Miranda C, Morris W, Naylor J, Raymond C, Rosetti M, Santos R, Sheridan A, Sougnez C, Stange-Thomann Y, Stojanovic N, Subramanian A, Wyman D, Rogers J, Sulston J, Ainscough R, Beck S, Bentley D, Burton J, Clee C, Carter N, Coulson A, Deadman R, Deloukas P, Dunham A, Dunham I, Durbin R, French L, Grafham D, Gregory S, Hubbard T, Humphray S, Hunt A, Jones M, Lloyd C, McMurray A, Matthews L, Mercer S, Milne S, Mullikin JC, Mungall A, Plumb R, Ross M, Shownkeen R, Sims S, Waterston RH, Wilson RK, Hillier LW, McPherson JD, Marra MA, Mardis ER, Fulton LA, Chinwalla AT, Pepin KH, Gish WR, Chissoe SL, Wendl MC, Delehaunty KD, Miner TL, Delehaunty A, Kramer JB, Cook LL, Fulton RS, Johnson DL, Minx PJ, Clifton SW, Hawkins T, Branscomb E, Predki P, Richardson P, Wenning S, Slezak T, Doggett N, Cheng JF, Olsen A, Lucas S, Elkin C, Uberbacher E, Frazier M, Gibbs RA, Muzny DM, Scherer SE, Bouck JB, Sodergren EJ, Worley KC, Rives CM, Gorrell JH, Metzker ML, Naylor SL, Kucherlapati RS, Nelson DL, Weinstock GM, Sakaki Y, Fujiyama A, Hattori M, Yada T, Toyoda A, Itoh T, Kawagoe C, Watanabe H, Totoki Y, Taylor T, Weissenbach J, Heilig R, Saurin W, Artiguenave F, Brottier P, Bruls T, Pelletier E, Robert C, Wincker P, Smith DR, Doucette-Stamm L, Rubenfield M, Weinstock K, Lee HM, Dubois J, Rosenthal A, Platzer M, Nyakatura G, Taudien S, Rump A, Yang H, Yu J, Wang J, Huang G, Gu J, Hood L, Rowen L, Madan A, Qin S, Davis RW, Federspiel NA, Abola AP, Proctor MJ, Myers RM, Schmutz J, Dickson M, Grimwood J, Cox DR, Olson MV, Kaul R, Raymond C, Shimizu N, Kawasaki K, Minoshima S, Evans GA, Athanasiou M, Schultz R, Roe BA, Chen F, Pan H, Ramser J, Lehrach H, Reinhardt R, McCombie WR, de la Bastide M, Dedhia N, Blöcker H, Hornischer K, Nordsiek G, Agarwala R, Aravind L, Bailey JA, Bateman A, Batzoglou S, Birney E, Bork P, Brown DG, Burge CB, Cerutti L, Chen HC, Church D, Clamp M, Copley RR, Doerks T, Eddy SR, Eichler EE, Furey TS, Galagan J, Gilbert JG, Harmon C, Hayashizaki Y, Haussler D, Hermjakob H, Hokamp K, Jang W, Johnson LS, Jones TA, Kasif S, Kaspryzk A, Kennedy S, Kent WJ, Kitts P, Koonin EV, Korf I, Kulp D, Lancet D, Lowe TM, McLysaght A, Mikkelsen T, Moran JV, Mulder N, Pollara VJ, Ponting CP, Schuler G, Schultz J, Slater G, Smit AF, Stupka E, Szustakowki J, Thierry-Mieg D, Thierry-Mieg J, Wagner L, Wallis J, Wheeler R, Williams A, Wolf YI, Wolfe KH, Yang SP, Yeh RF, Collins F, Guyer MS, Peterson J, Felsenfeld A, Wetterstrand KA, Patrinos A, Morgan MJ, de Jong P, Catanese JJ, Osoegawa K, Shizuya H, Choi S, Chen YJ, Szustakowki J (February 2001). «Initial sequencing and analysis of the human genome». Nature 409 (6822): 860-921. Bibcode:2001Natur.409..860L. PMID 11237011. doi:10.1038/35057062.
- Jorde LB, Bamshad M, Rogers AR (February 1998). «Using mitochondrial and nuclear DNA markers to reconstruct human evolution». BioEssays 20 (2): 126-36. PMID 9631658. doi:10.1002/(SICI)1521-1878(199802)20:2<126::AID-BIES5>3.0.CO;2-R. Archivado desde el original el 28 de noviembre de 2007. Consultado el 28 de octubre de 2007.
- Jorde LB, Watkins WS, Bamshad MJ, Dixon ME, Ricker CE, Seielstad MT, Batzer MA (March 2000). «The distribution of human genetic diversity: a comparison of mitochondrial, autosomal, and Y-chromosome data». American Journal of Human Genetics 66 (3): 979-88. PMC 1288178. PMID 10712212. doi:10.1086/302825.
- Jorde LB, Watkins WS, Kere J, Nyman D, Eriksson AW (2000). «Gene mapping in isolated populations: new roles for old friends?». Human Heredity 50 (1): 57-65. PMID 10545758. doi:10.1159/000022891.
- Kaessmann H, Heissig F, von Haeseler A, Pääbo S (May 1999). «DNA sequence variation in a non-coding region of low recombination on the human X chromosome». Nature Genetics 22 (1): 78-81. PMID 10319866. doi:10.1038/8785.
- Kaessmann H, Wiebe V, Weiss G, Pääbo S (February 2001). «Great ape DNA sequences reveal a reduced diversity and an expansion in humans». Nature Genetics 27 (2): 155-56. PMID 11175781. doi:10.1038/84773.
- Keita SO, Kittles RA (1997). «The Persistence of Racial Thinking and the Myth of Racial Divergence». American Anthropologist 99 (3): 534-44. doi:10.1525/aa.1997.99.3.534.
- Marks J (1995). Human Biodiversity: Genes, Race, and History. Aldine Transaction. ISBN 978-0-202-02033-4.
- Mountain JL, Risch N (November 2004). «Assessing genetic contributions to phenotypic differences among 'racial' and 'ethnic' groups». Nature Genetics 36 (11 Suppl): S48-53. PMID 15508003. doi:10.1038/ng1456.
- Pääbo S (January 2003). «The mosaic that is our genome». Nature 421 (6921): 409-12. Bibcode:2003Natur.421..409P. PMID 12540910. doi:10.1038/nature01400.
- Ramachandran S, Deshpande O, Roseman CC, Rosenberg NA, Feldman MW, Cavalli-Sforza LL (November 2005). «Support from the relationship of genetic and geographic distance in human populations for a serial founder effect originating in Africa». Proceedings of the National Academy of Sciences of the United States of America 102 (44): 15942-47. Bibcode:2005PNAS..10215942R. PMC 1276087. PMID 16243969. doi:10.1073/pnas.0507611102.
- Relethford JH (August 2002). «Apportionment of global human genetic diversity based on craniometrics and skin color». American Journal of Physical Anthropology 118 (4): 393-98. PMID 12124919. doi:10.1002/ajpa.10079.
- Sankar P, Cho MK (November 2002). «Genetics. Toward a new vocabulary of human genetic variation». Science 298 (5597): 1337-38. PMC 2271140. PMID 12434037. doi:10.1126/science.1074447.
- Sankar P, Cho MK, Condit CM, Hunt LM, Koenig B, Marshall P, Lee SS, Spicer P (June 2004). «Genetic research and health disparities». JAMA 291 (24): 2985-89. PMC 2271142. PMID 15213210. doi:10.1001/jama.291.24.2985.
- Serre D, Pääbo S (September 2004). «Evidence for gradients of human genetic diversity within and among continents». Genome Research 14 (9): 1679-85. PMC 515312. PMID 15342553. doi:10.1101/gr.2529604.
- Templeton AR (1998). «Human Races: A Genetic and Evolutionary Perspective». American Anthropologist 100 (3): 632-50. doi:10.1525/aa.1998.100.3.632.
- Weiss KM (1998). «Coming to Terms with Human Variation». Annual Review of Anthropology 27: 273-300. doi:10.1146/annurev.anthro.27.1.273.
- Weiss KM, Terwilliger JD (October 2000). «How many diseases does it take to map a gene with SNPs?». Nature Genetics 26 (2): 151-57. PMID 11017069. doi:10.1038/79866.
- Yu N, Jensen-Seaman MI, Chemnick L, Kidd JR, Deinard AS, Ryder O, Kidd KK, Li WH (August 2003). «Low nucleotide diversity in chimpanzees and bonobos». Genetics 164 (4): 1511-18. PMC 1462640. PMID 12930756.
- Zietkiewicz E, Yotova V, Gehl D, Wambach T, Arrieta I, Batzer M, Cole DE, Hechtman P, Kaplan F, Modiano D, Moisan JP, Michalski R, Labuda D (November 2003). «Haplotypes in the dystrophin DNA segment point to a mosaic origin of modern human diversity». American Journal of Human Genetics 73 (5): 994-1015. PMC 1180505. PMID 14513410. doi:10.1086/378777.
- Pennisi E (December 2007). «Breakthrough of the year. Human genetic variation». Science 318 (5858): 1842-43. PMID 18096770. doi:10.1126/science.318.5858.1842.
- Ramachandran S, Tang H, Gutenkunst RN, Bustamante CD (2010). «Genetics and Genomics of Human Population Structure». En Speicher MR, Antonarakis SE, Motulsky AG, ed. Vogel and Motulsky's Human Genetics: Problems and Approaches (4th edición). Springer. ISBN 978-3-540-37653-8.
